电解铜箔制造技术讲座(连载十二)
电解铜箔制造技术讲座(连载十二)
任中文 编著
第十章 铜箔的电解加工原理及其品质影响因素
10.1铜箔的电解加工原理
10.1.1铜箔的电解加工是一个铜电沉积过程
电解制造铜箔(确切讲是电解铜箔的“生箔”)是以水溶液CuSO4溶液为电解液,液中含有Cu++、H+及其它微量的金属离子等阳离子,还含有SO42-、Cl-等阴离子。另外还有微量有机物明胶等在电解液中显正电性的分子团。这个过程,是一个通过电极反应的铜电沉积过程。
电极反应是一种异相反应,在有外电源的作用下,阳离子移向阴极,阴离子移向阳极,由于Cu++、H+及其它金属阳离子和有机物的析出电位不同,在阴极上主要有Cu++还原为Cu。在阳极上有SO42-放电析出O2和部分SO2气体。如果阳极采用Pb-Ag合金板,阳极工作时发生溶解:
Pb+SO42-—PbSO4↓+2e(式10-1)
10.1.2铜电沉积的基本过程
铜电沉积是阴极反应过程,一般由以下几个单元步骤串联组成:
(1)铜离子在液中的迁移,电解液中的水化Cu++向电极表面迁移;
(2)Cu++迁移到阴极电极表面附近发生化学转化反应,即水化Cu++的脱水,水化程度降低和重排。
(3)电荷传递,Cu++得到电子,还原为吸附态Cu++。
(4)电结晶,新生的吸附态金属原子沿电极表面扩散到适当位置与其它铜原子生成金属晶格,之后晶格相连成金属铜。
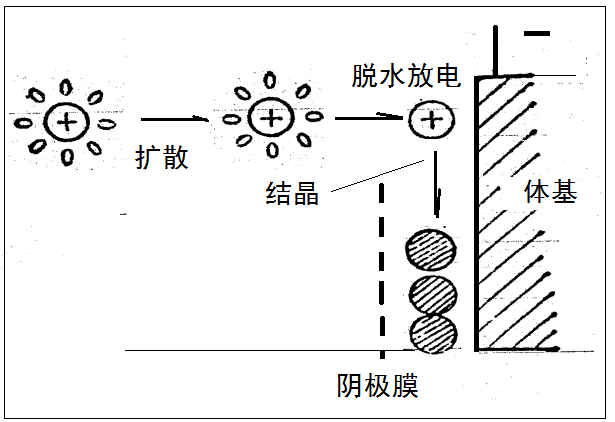
图10-1水化离子放电过程
Cu++在水溶液中都是以水化离子形式存在的,Cu++在阴极还原时必须首先发生水化离子周围水分子的重排和水化程度的降低,才能实现电子在电极与水化离子之间的跃迁,形成部分脱水化膜的吸附在电极表面的所谓吸附原子。这种原子还可能带有部分电荷,因而也有人称之为吸附离子,然后这些吸附原子脱去剩余的水化膜,成为金属原子。
电化学生产中水是常用的溶剂,由于水分子中正电荷“重心”和负电荷“重心”不相重合,因此它是一个永久偶极分子。
电沉积过程包括两个方面,即Cu++在阴极还原析出Cu的过程和新生态Cu在电极表面的电结晶过程,由于在电沉积过程中电极表面不断生成新的晶体,表面状态不断变化,使得金属阴极还原过程的动力学规律复杂化,同时又受到阴极界面电场的作用,相互依存,相互影响,造成了Cu电沉积过程的复杂性和不同于其他电极过程的一些特点。
(1)阴极过电位是电沉积过程进行的动力,阴极电沉积过程中不仅Cu的析出需要一定的阴极过电位,还要达到一定的极化值,只有达到一定的临界尺寸的晶核才能稳定存在,凡是达不到临界尺寸的晶核就会重新溶解,阴极过电位愈大,晶核生成功愈小,形成晶核的临界尺寸才能减小,这样生成的晶核既小又多;结晶才能细致,阴极过电位决定铜箔的结晶组织结构,结晶取向。
(2)各种粒子在阴极紧密层中的吸附对电沉积过程有明显影响,Cu+和其它粒子吸附,即使是微量的吸附,都将在很大程度上影响Cu++的阴极析出速度和析出位置,又影响随后的金属结晶方式和致密性。(3)铜箔的晶体结构、性能与电结晶过程中新晶粒的生长方式和过程密切相关,同时与电极表面的结晶状态密切相关。
10.1.3 铜箔的细化结晶原理
由于电结晶过程是在一定过电位下从不平衡态向平衡态转化的自发过程,使体系自由能降低,其数值用△G'表示。当新相生成时又形成新的界面,使体系自由能又升高(新相形成功),其数值用△G2表示。所以,结晶过程中体系能量总的变化应是这两部分之和,即△G=△G'+△G2。如果从相界面能的变化考虑,最有利的2维晶核形状是园柱形。假设2维园柱体晶核半径为r,高h为(一个原子高)。则可推导出形成2维晶核时体系自由能的总变化△G为:
△G=-πr2hpnFηc/A+2πrhδ1+πr2(δ1+δ2-δ3)
其中:△G1=-πr2hpnFηc/A△
G2=2πrhδ1+πr2(δ1+δ2-δ3) (10-2)
式中:n:金属离子的价数;F:法拉第常数;p:沉积金属的密度;A:沉积金属相对原子质量;ηc:阴极过电位;δ1:晶核/溶液界面张力;δ2:晶核/电极界面张力;δ3:电极/溶液的界面张力。
按照化学热力学原理,只有△G<0时,即△G1>△G2晶核才能稳定存在。而从式(10-2)可看出,△G是晶核半径r的函数。当r较小时,晶核的比表面很大,体系自由能的降低△G1不足以补偿新相生成的形成功△G,故△G>0,此时形成的晶核是不稳定的,会重新进入溶液,当r较大时,晶核的比表面小|△G1|>|△G2|,则△G<0,可以形成稳定的晶核。因此,可以通过△G对r的微分,在∂△G/∂r=0的条件下求出使晶核稳定存在的晶核临界半径比(rc):
rc:rc=hδ1/[hpnFηc/A-(δ1+δ2-δ3)] (10-3)
将(10-3 )代入(10-2),得到临界自由能变化△Gc:
△Gc=πh2δ12[hpn Fηc/A-(δ1+δ2-δ3)] (10-4)
显然只有半径大于rc的晶核,才能有效存在并长大。同时,式(5—1)还表明,过电位越高,晶核临界半径越小。如果阴极过电位很高,使|△G'|>>|∆G2|;或者在完整覆盖了沉积金属原子的第一层上继续电结晶时,因δ1=δ3,δ2=0,,则公式 (10-4)可简化为:
△Gc=πhδ21A/pnFηc (10-5)
已知形核速度v和临界自由能变化△Gc之间有如下关系。
v=Kexp(-△Gc/ST) (10-6)
式中:K:指前因子;S:波尔兹曼常量;S=R/L;R:摩尔气体常量;L:阿佛加德罗常量。
将(10-5)代入(10-6) 式,则:
v=Kexp(-πhδ21LA/PnFRTηc) (10-7)
式10-7表明了电结晶过程中形核速度与阴极过电位的关系,nc越小形核速度越小,ηc越大,形核速度越大。随着控制阴极过电位的提高,晶核形成速度是以指数关系急剧增加的,因而结晶更加细致。
10.1.4 对影响铜电结晶过程几个因素的认识
在理论上只要阴极的电位负于铜在溶液中的平衡电位,并获得一定过电位时,铜离子就可以在阴极上析出。但事实上并不这么简单,因为溶液中存在多种可以在阴极还原的粒子,这些粒子,尤其是氢离子将与铜离子竞争还原。因此铜离子能否从溶液中在阴极上还原,不仅取决于其本身的电化学性质,而且还取决于溶液中其他粒子的电化学性质。铜箔生产实践证明了这一点,如明胶含量的高低,铜箔的结晶组织是不一样的,电流密度大与小,电解液中的各种杂质含量多少都会改变铜箔的内部组织结构。
这样,我们需要深入对影响铜电结晶过程重要因素的认识。以下,分别对电迁移、电结晶形核过程等作以讨论。
(1)电迁移的影响
电解液中的Cu++在电场作用下沿着一定方向移动,这种现象叫电迁移。
电化学体系是由阴极、阳极和电解质溶液组成的,当电化学体系中有电流通过时,阴极和阳极之间就会形成电场。在这个电场的作用下,电解液中的阳离子定向地向阴极移动,而阴离子定向地向阳极移动,由于这种带电粒子的定向运动,使得电解质溶液具有导电性能。应该指出一点,通过电迁移作用而传输到电极表面附近的离子有些是参与电极反应的,有一些则不参加电极反应,起到传导电流的作用。由于电迁移作用而使电极表面附近溶液中Cu++浓度发生变化的数量,可用电迁流量来表示,
Qi=±Ciui=±CiviE (10-8)
式中:Qi:i离子电迁流量mol/cm2s; Ci:i离子浓度mol/cm3;vi:i离子电迁移速度cm/s;vi:i离子淌度cm2/sv;E:电场强度v/cm;±:+表示阳离子电迁移,-表示阴离子电迁移。
式10-8告诉我们:铜箔生产需要较大的电解液流量来保证Cu++浓度。大流量才有大流速,用大流速实现电解液的强制对流,来达到电极表面附近电解液流层中的Cu++浓度的变化量稳定。强制对流的外力,一是泵直接向电解槽里输送,二是靠高位槽有较大的位差,增加势能,达到增大流量的目的。
在电解时,阴极上发生铜阳离子的还原反应时,电迁移与扩散作用两者方向相同。
(2)铜电结晶过程的影响
电极过程,反应粒子(离子、分子等)向电极表面附近液层迁移的速度,是电极过程的第一步,关系到浓差极化,关系到H+能否析出。
反应粒子在电极表面或电极表面附近液层中进行电化学反应前的某种转化程度,如反应粒子在电极表面的吸附或其它化学变化。这个过程是没有电子参与的反应,反应速度与电极电位无关。与电场强度有关。
反应粒子在电极/溶液界面上得到或失去电子,生成还原反应或氧化反应的产物,这是电子参与的反应,与电极电位有关,这一过程称为电子转移步骤或电化学反应步骤。反应生成物在电极表面或表面附近液层中进行电化学反应后的转化过程,如:反应产物自电极表面脱附,反应产物的复合、分解、岐化或其它化学变化。这一过程称为随后的表面转化步骤,与电极的过电位值有直接关系。最后的反应产物——生成新相,气体、水、固相沉积层等。
铜电结晶过程是在电场作用下完成的,因此电结晶过程受到阴极表面状态,电极附近溶液的化学和电化学过程,特别是阴极极化作用(过电位)等许多特殊的因素的影响,而且有自己独特的动力学规律,电结晶过程有二种形式,一是阴极还原的新生态吸附原子聚集形成晶核,晶核逐渐长大形成晶体,一是新生态吸附原子在电极表面扩散,达到某一位置并进入晶格,在原有金属的晶格上延续生长。 金属的电结晶与盐从过饱和溶液中结晶过程有类似之处,当盐溶液浓度超过饱和以后,将会从溶液中以固体状态结晶出来,过饱和度愈大,结晶出来的晶体晶粒愈小。过饱和度愈小,则晶粒愈粗大。
金属的电结晶是一个电化学过程,形核和晶粒长大所需要的能量来自于界面电场,即电结晶的推动力是阴极过电位,而不是溶液的过饱和度。开始通电时,在阴极上没有金属析出,阴极电位迅速负移,说明阴极电流消耗于电极表面的充电,当电位负移到一定值时,电极表面才出现金属的沉积。说明开始有金属离子还原和生成晶核,由于晶核长大需要的能量比形成晶核时少,所以电位减小。
过电位使电极体系能量升高,即由外电源提供生成晶核和晶核长大所需要的能量,所以,一定的过电位是电结晶过程发生的必要条件。在完整的晶体表面电沉积时首先形成二维晶核,再逐渐生长成为“单原子”薄层,然后在新的晶面上再次形核长大,一层一层生长,直至成为宏观的晶体沉积层。
由于电结晶过程是在一定过电位下从不平衡态向平衡态转化的自发过程,使体系自由能降低。但新相生成时要形成新的界面,又使体系自由能升高,结晶过程中体系能量总的变化是这两部分变化之和。如果从界面能的变化考虑,最有利的二维晶核形状是圆柱形。按照化学热力学原理,只有总能量大于O,晶核才能稳定存在。
电结晶形核过程有两点重要规律:
(a)电结晶时形成晶核要消耗电能,生产过程中阴极的过电位是靠电能来保证的。
(b)阴极过电位的大小决定着电结晶层的粗细程度,阴极过电位高则晶核愈容易形成,晶核的数量也愈多,沉积层结晶细致,相反阴极过电位愈小,沉积层晶粒愈粗大。
10.1.5 铜在已有晶面上的延续生长
关于铜在阴极上是如何电沉积结晶的,一百多年来有很多说法,归纳起来,被大多数人支持的有以下两种意见。
(1)表面扩散与并入晶格。
吸附原子可以两种方式并入晶格:放电粒子直接在生长点放电而就地并入晶格(见图10-2中的a);放电粒子在电极表面任一位置放电,形成吸附原子,然后扩散到生长点并入晶格,(见图10-2中的b)
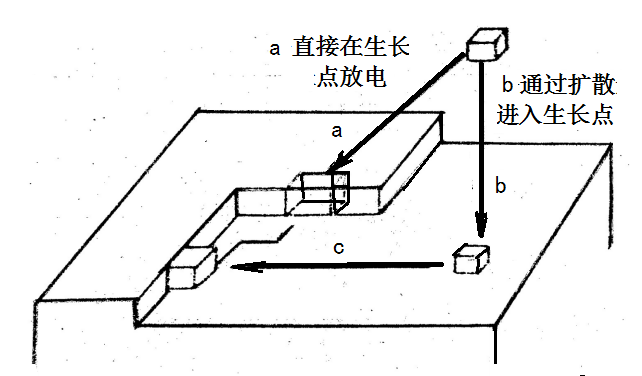
图10-2 金属离子并入晶格的方式
吸附原子并入晶格过程的活化能涉及两方面的能量变化:电子转移和反应粒子脱去水化层所需要的能量△G1;吸附原子并入晶格所释放的能量△G2。
通常Cu++在电极表面不同位置放电脱水化程度不同,故△G1能量明显不同,而在不同缺陷处并入晶格时释放的能量△G2差别却不大。
表10-1 Cu++在不同位置放电时的活化能(KJ/mol)
Cu++放电位置 | 晶面 | 棱边 | 扭结点 | 空穴 |
活化能(KJ/mol) | 544.3 | 753.6 | >753.6 | 753.6 |
Cu++在不同位置放电所需的活化能,证明这一点,直接在生长点放电,并入晶格时,要完全脱去水化层,△G1很大,故这种并入晶格方式的几率很小;而在电极表面平面位置放电所需的△G1最小,虽然有些时△G2比直接并入晶格时稍大一些,总的活化能仍然最小,所以这种方式出现的几率最大。
(2)晶体的螺旋位错生长
实际晶体表面有很多位错,有时位错密度可高达1010—1012个/cm2。晶面上的吸附原子扩散到位错的台阶边缘时,可沿位错线生长,如图10-3所示。
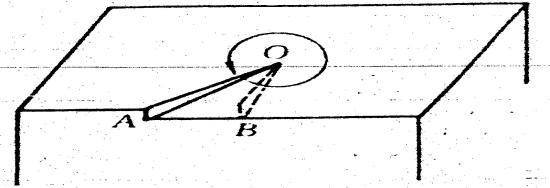
图10-3 螺旋位错生长示意图
开始时,晶面上的吸附原子扩散到位错的扭结点O,从O点开始逐渐把位错线OA填满,将位错线推进到OB,原有的位错线消失,新的位错线OB形成。吸附原子又在新的位错线上生长,位错线推进一周后,晶体就向上生长了一个原子层,如此反复旋转生长,晶体将沿位错线螺旋式长大,成为图5—20 所示的棱锥体。
|
图10-4 位错螺旋推进生长成棱锥体示意图
随着相关学科以及电化学测试与表面分析技术的发展,人们逐渐有了比较一致的观点,电结晶过程中的形核和螺旋位错生长都是客观存在的结晶方式。当阴极过电位较小时,电极过程的动力较小。电结晶过程主要通过吸附原子表面扩散并入晶格,以螺旋位错生长方式进行,此时,由于吸附原子浓度和扩散速度都相当小,表面扩散步骤成为电沉积过程的速度控制步骤,当阴极过电位比较高时,电极过程动力增大,吸附原子浓度增加。容易形成新的晶核并长大,故电结晶过程主要以形核方式进行。与此同时电极过程速度控制步骤也转化为电子转移步骤。
10.2铜结晶生长的实验及其认识
我们在研究、制定电解铜箔电解加工的工艺中,是建立在对铜结晶生长过程认识的基础上的。因此实验铜结晶生长的实验及手段,就是一件重要需要工艺技术人员要做的,或者是要了解的事情了。
大约在2001年,南京大学物理教研组对铜的电沉积过程进行了实验,并把铜沉积的过程用隧道电子显微镜摄录下来。,这项试验过程,我看到了在2002年初,中央电视台在科技博览节目中得到播放。 实验的工艺条件和阴、阳极的材料我都不清楚,我只是看到了播放铜的电结晶过程。虽然没有看的完整,但我感到十分的满足,感谢南京大学的老师和中央电视台。
我看到“铜离子在阴极表面还原成原子,然后长成一个正方形的晶格。此时这个晶格还在漂移,接下来两个正方形晶格叠加起来,生成一个长方形铜晶格,长在阴极上”。在这里我看到了铜的生长是先形成正方形的晶格,而后两个正方形的晶格叠加起来,生长成一个长方形的晶格,然后才沉积在阴极上的。不是单个铜原子沉积,铜晶格也不是任意沉积,是有固定沉积位置的。 有人说,第一个还原的原子就是这个晶核的核心,其它还原的原子与核心原子长成一个正方形的晶格;晶格在这生成,不一定在这沉积。
在实验中铜先长成一个看上去像个正方体的晶体,之后,新生成的两个正方体叠加在一起又成为一个长方体。这个长方体才是铜的晶粒最小组织——晶格,晶格在阴极表面移动一下就长上了。我认为此点一定是阴极辊上一个完整的晶粒的边沿。也有人说,阴极辊表面因为磨辊造成很多地方的晶格不完整。铜的长方体晶格不会长在这里,应该长在阴极辊表面完整的晶格的晶轴上。我对此还是有自己的看法,没有依据。
以前关于铜结晶的众多说法,被眼前实验的结果打破了。我亲眼看到的是:
铜的晶格(长方体)形状在阴极上沉积,之后第二个晶格(是同样的长方体)接着第一个晶格向前生长。当第二个晶格生长的同时,在第一和第二个晶格相接处,大约以45度夹角长出枝杈,枝杈是同样的长方体(和第一个晶格完全一样)如图10-5 ,铜结晶时的晶格是围绕两个晶格相接点向周围生长枝杈,是立体的生长,和树的生长完全一样。
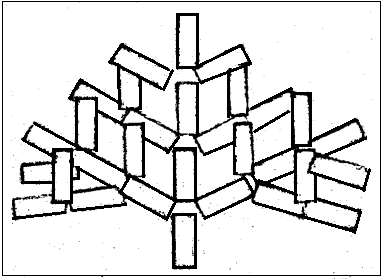
图10-5铜结晶平面示意图
在外电源的作用下,铜继续沉积,每次沉积生长上去的都是同样的长方体晶格,无论是铜树主干还是枝杈继续向前生长时,每长出一节晶格,在这个晶格生长点的地方都以大约45度夹角长出枝杈。每个枝杈都是同样的长方体晶格,最后长成一棵铜树。众多的铜树形成铜层—铜箔,如图10-6。
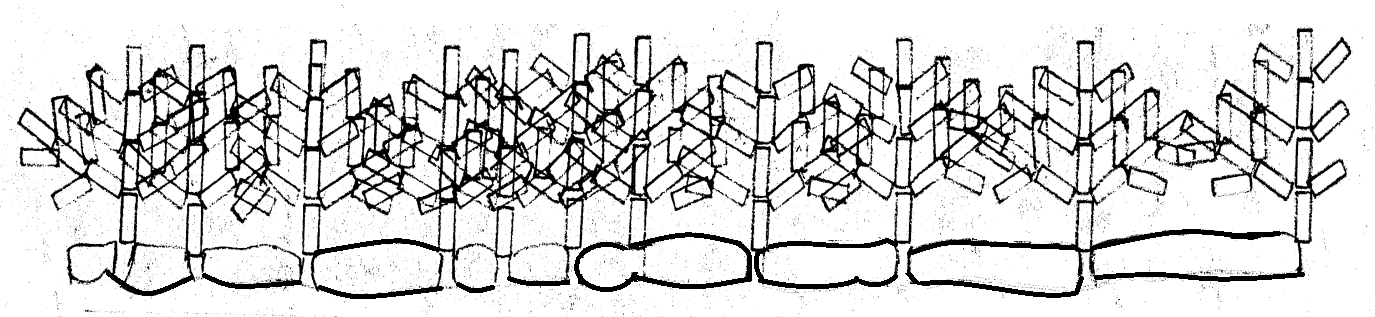
图10-6铜箔形成平面示意图
在图10-6中我们看到,铜树生长的距离不一样,有的两棵树根距离大,有的距离小。我是有意这样设计的,目的是说明阴极辊表面晶粒大小对铜箔的影响。从图10-6中我们可以看到,阴极辊晶粒小,铜树生长的距离小,长出第一或第二个枝杈时已相互连接起来。这种枝杈与主干相连是最结实的,之后枝杈越来越密集,这些枝杈距主干都很近,很结实。表示铜箔结晶致密厚实,没有孔隙。反之,阴极辊晶粒大,铜树根距离大的,枝杈长到第四、第五节时才相互连接起来,越是树梢,越不结实。所以这种铜层不结实,松散不抗拉,延伸率低。( 电视播放时看的很清楚)此时铜箔的厚度已经达到要求了,停止沉积了。这里的铜箔结晶组织实际松弛孔隙多,实际厚度很薄,结晶组织中存留的气体多,而且是“树梢”相连,相连的枝杈不密集。铜层不厚实,承载力很差。 我们大家都学过平面几何,都懂得“点”成“线”,“点”成“面”的道理,比如:一万个黑点组成一个黑面,九千个点远看已经是个黑面了,七千个点也接近是一个黑面了,所以,七千个点就是我们需要的。但,七千个点必须是均匀分布的,才是一个平整的黑面,如果不均匀,就是一个黑白相间的花面。
如果阴极辊的晶粒细小均匀,铜箔初始生长的点多而密集,已经成面了。这对生产超薄铜箔极为有利,这使铜箔的真实厚度增加了,受力层实成了,工作层厚了,“桥洞”少了,这才是我们希望的。
这就是我十多年来,一直呼吁的问题,阴极辊钛表面的晶粒要细小,均匀一致。铜离子在钛晶界放电和在添加剂上放电获得的能量是不一样的,结晶自然是不一样的。这才是生产高档铜箔所急需的阴极辊,请国内生产阴极辊的人们不要再忽悠我们了。
南大的这个实验,帮我解开了很多的谜团:铜结晶是先在阴极表面形成晶格,之后以一个晶格的方式沉积在阴极辊晶粒的边沿。这是没有添加剂干扰的情况下自然沉积的,如有添加剂干扰一定会改变这种结晶状态。 在生产实际中,不同的添加剂生产出不同的铜箔,这已在生产实际中证明。不同的添加剂导致阴极过电位不同,铜以不同的晶格在阴极表面沉积。如:生产低轮廓铜箔,添加剂使阴极过电位很大时,可能会以正方体的晶格沉积,这可能就是石子状结晶。再有生产双面光铜箔时,溶液中象硫脲类极强的络合剂配合,使阴极过电位更大,结晶晶格高度更小,这可能就是片状结晶。
在添加剂的作用下,尽管铜箔某几方面的指标达到了用户的要求,但,铜箔的金属性能下降很多了,原因是铜箔中夹带着有机添加剂,如图10-7。
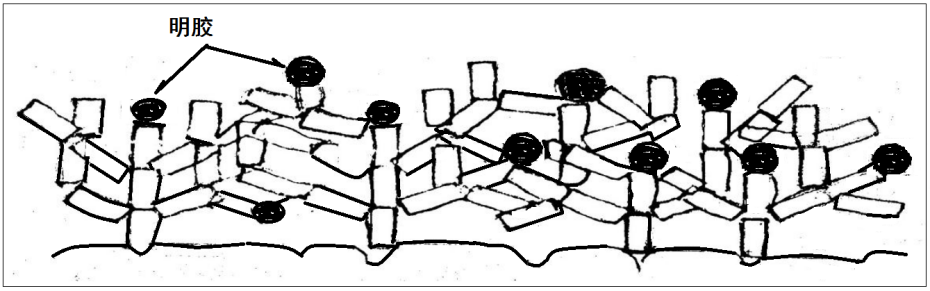
图10-7电解液中添加明胶沉积的铜箔平面示意图
(图中的“黑点”为明胶)
日本铜箔专家北村讲,“一台生箔机一日生产的铜箔里夹带明胶量为K×(30~120)克”。
明胶等添加剂在铜箔里占据了铜晶粒的位置,保持了铜箔厚度,而明胶与铜不是一体,受外力作用时会分离的,明胶与铜箔变形是不一样的。受外界温度变化时收缩膨胀系数的差别是很大的,当有电流时明胶就起阻碍作用了,电阻就大了;当称重时,明胶轻,铜箔的比重就小了;当铜箔里夹带的添加剂多了,孔隙、空洞、含氧、含氢必然就多。铜箔的真实比重肯定低,这也是衡量铜箔档次的一项重要标准。大陆铜箔的比重普遍在7.8~8.2g/cm3,超过8.4g/cm3根本没有。超过8g/cm3的有机物夹杂量已经较高了。
(未完,待续)